Lithium (Li)
Lithium (Li)
Schrägbeziehung zu Magnesium
Lithium gibt beim Verbrennen an der Luft ![]() und nicht
und nicht ![]() wie Na, das zu
wie Na, das zu ![]() wird. Die Löslichkeit von Lithiumsalzen ist denen von Magnesiumsalzen ähnlicher als denen von Natriumsalzen.
wird. Die Löslichkeit von Lithiumsalzen ist denen von Magnesiumsalzen ähnlicher als denen von Natriumsalzen.
![]() und
und ![]() sind so wie
sind so wie ![]() und
und ![]() schwerlöslich, während Na-Carbonat (
schwerlöslich, während Na-Carbonat (![]() ) und –Phosphat (
) und –Phosphat (![]() ) leicht löslich sind. (u.a.m.)
) leicht löslich sind. (u.a.m.)
Vorkommen
Als Begleiter des Natriums und Kaliums in silikatischen Gesteinen in geringen Mengen.
Li-Minerale:
- (Li,Na)
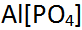 (F,OH)
(F,OH) 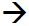 Amblygonit
Amblygonit - LiAl
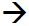 Spodumen
Spodumen 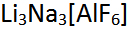
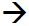 Kryolithionit
Kryolithionit
Gewinnung
Durch Schmelzelektrolyse aus LiCl.
Chemische Eigenschaften
Lithium verbrennt mit Sauerstoff mit intensiv-rotem Licht zu ![]() , mit Stickstoff reagiert es schon bei 25°C zu Lithiumnitrid
, mit Stickstoff reagiert es schon bei 25°C zu Lithiumnitrid ![]() , mit Kohlenstoff zu Lithiumcarbid
, mit Kohlenstoff zu Lithiumcarbid ![]() , mit Schwefel zu Lithiumsulfid
, mit Schwefel zu Lithiumsulfid ![]() und mit Phosphor zu Lithiumphosphid
und mit Phosphor zu Lithiumphosphid ![]() .
.
Die Reaktion mit Wasser ist weniger heftig als die von Na und K, LiOH ist eine starke Base.
![]() löst sich auch in organischen Lösungsmitteln wie Alkohol und Ether.
löst sich auch in organischen Lösungsmitteln wie Alkohol und Ether.