Wasserstoff (H)
Wasserstoff (H)
Wasserstoff nimmt im Periodensystem eine Sonderstellung ein. Er hat nur ein Valenzelektron und ist mit den Alkalimetallen vergleichbar. Es fehlt ihm aber nur ein Elektron um die Edelgaskonfiguration zu erreichen. Damit ist er mit den Halogenen (7. Hauptgruppe) vergleichbar. Er ist elektronegativer als die Elemente der ersten Hauptgruppe und weniger elektronegativ als die Elemente der siebenten Hauptgruppen. Die Eigenschaften des Wasserstoffs sind hauptsächlich durch seinen kleinen Atomradius geprägt.
Vorkommen
Ca. 15% aller Atome im Bereich der Erdoberfläche sind Wasserstoffatome. Wegen der geringen Masse des Wasserstoffatoms beträgt der Massenanteil jedoch nur 0,9%. Wasserstoff besteht aus H2 Molekülen. Er ist ein farb- und geruchloses Gas.
Gewinnung
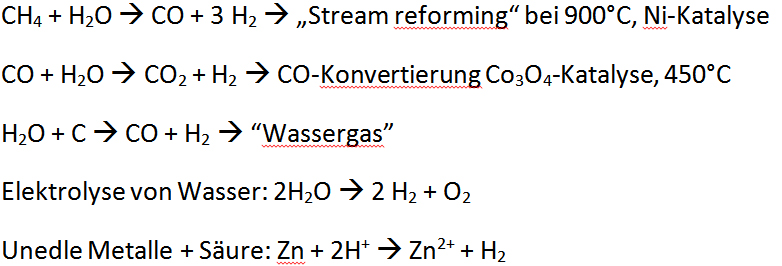
Chemische Eigenschaften
Wasser bildet mit Alkali- und Erdalkalimetallen (außer Be) Hydride in denen er als Hydridion![]() vorliegt. Er ist damit isoelektronisch zum He.
Diese Hydride sind als Hydrierungsmittel im Einsatz, auch komplexe Hydride, wie
vorliegt. Er ist damit isoelektronisch zum He.
Diese Hydride sind als Hydrierungsmittel im Einsatz, auch komplexe Hydride, wie ![]() ,
, ![]() .
.
Wasserstoff reagiert mit Sauerstoff unter Explosion zu Wasser (Knallgas), ebenso heftig reagiert er mit Halogenen unter Ausbildung der Halogenwasserstoffe.
Die Reaktion von Schwefel mit Wasserstoff erfordert Energie und einen Katalysator, ![]() und
und ![]() reagieren unter hohe Druck und hoher Temperatur. Ähnliche Bedingungen für die Reaktion von C mit
reagieren unter hohe Druck und hoher Temperatur. Ähnliche Bedingungen für die Reaktion von C mit ![]() .
In Wasserstoffverbindungen mit Nichtmetallen liegen kovalente Bindungen vor, in denen der Wasserstoff der elektropositivere Partner ist.
Wasserstoff wird als Reduktionsmittel verwendet.
.
In Wasserstoffverbindungen mit Nichtmetallen liegen kovalente Bindungen vor, in denen der Wasserstoff der elektropositivere Partner ist.
Wasserstoff wird als Reduktionsmittel verwendet.